家长留言怎么写小学:寄语孩子成长的温馨与期望
2024-08-06
课时:1小时
教学目的:
使学生掌握物质的量及其单位——摩尔的概念,理解物质的量与微观粒子数之间的关系。
了解摩尔质量的概念及其应用。
掌握物质的量、摩尔质量、物质质量之间的关系。
教学重点:物质的量及其单位
教学过程:
一、引入概念
18克水可以用托盘天平称量,但单个水分子却无法称量。同样地,一把大米可以轻易称重,但一粒大米却无法准确测量。然而,我们可以通过物质的量这一概念,将微观粒子与可称量的物质联系起来。
二、物质的量
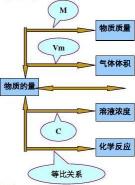
物质的量是国际单位制的7个基本单位之一,用于描述一定数目的微观粒子。它的符号是“n”。
物质的量的单位是摩尔,简称摩。摩尔是表示含有一定数目粒子的集体的物理量。
阿伏加德罗常数是衡量一定数目的粒子的常量,大约为6.02×10^23个粒子。因此,1摩尔任何粒子的粒子数等于阿伏加德罗常数。
三、摩尔质量
摩尔质量描述了单位物质的量的物质所具有的质量。它的符号是“M”。
摩尔质量的单位是克/摩尔(g/mol)。
通过计算,我们可以得知1摩尔任何粒子的质量等于其相对原子质量或相对分子质量。换句话说,这个质量就是该粒子的摩尔质量。
四、应用与练习
通过一些例题和练习,让学生进一步理解和掌握物质的量、摩尔质量的概念及其计算方法。例如,计算0.1摩尔氢气中含有多少摩尔的氢原子,或者2摩尔甲烷中含有多少摩尔的碳原子和氢原子。同时,也可以让学生了解相对原子质量的计算方法。
五、小结与作业
总结本节课的主要内容,包括物质的量、摩尔、摩尔质量的概念及其应用。布置作业,让学生通过习题巩固所学知识。
免责声明:本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们
相关文章
2024-08-06
2024-08-05
2024-08-05
2024-08-05
2024-08-05
2024-08-05
2024-08-05
2024-08-05
2024-08-05
2024-08-05
2024-08-05
2024-08-05
2024-08-05
2024-08-05
站长推荐
超详细!麦当劳大薯条DIY制作,再也不用去快餐店排队
草莓慕斯蛋糕:美味与颜值并存的甜点
轰炸鸡排:美味炸鸡胸排的制作秘诀
美味健康的洋葱炒猪肝做法
轻松制作美味鸡尾包:详细步骤与技巧
家常洋白菜炒粉:美味不腻的快手菜
新奥尔良烤鸡翅:入味多汁的秘诀在这里!
家常美味:辣炒鱿鱼的做法详解
香酥麻花的制作方法与配方:咸甜皆宜的美味小食
家常美味:茄子炖土豆的制作方法
制作香甜可口的油香:简单易学的烹饪指南
十香菜搭配蔬菜鸡肉,美味健康的家常炒菜
枸杞泡茶:简单易做的滋补饮品
海参汤的家常做法:简单又美味
制作甜酒酿:糯米的艺术与酒药的魔法